[Diaporama] Des protéines photoconvertibles au service de la microscopie super-résolution
Publié par communication CNRS Alpes, le 3 mars 2025 170
Certains organismes vivants possèdent des protéines qui sont naturellement fluorescentes. Il en existe plusieurs sortes, parmi lesquelles les protéines dites photoconvertibles, c’est-à-dire qui dans certaines conditions, passent de manière irréversible d’un état de fluorescence vers un autre. À l’Institut de biologie structurale (IBS) de Grenoble, une équipe s’intéresse à des protéines présentes chez des organismes marins, afin d’améliorer leur comportement et développer de nouveaux marqueurs fluorescents. Ces marqueurs sont intéressants notamment dans le cas de la microscopie super-résolution, qui permet d’imager des objets à l’échelle nanométrique.

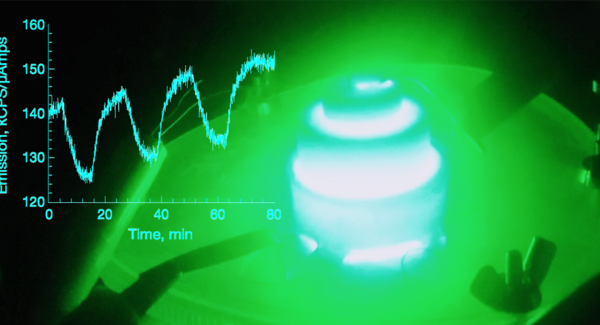
Un banc optique pour la microscopie super-résolution (ou « nanoscopie ») est utilisé pour la localisation de molécules uniques (SMLM). Cette technique repose sur l’utilisation de marqueurs fluorescents sous illumination laser. Sept lasers sont utilisés sur ce banc optique, qui doivent être parfaitement alignés. Leur réglage nécessite un contrôle manuel régulier.

Les lasers ont des longueurs d’onde variant de 405 nm à 730 nm. Pour optimiser le comportement de photoconvertibilité des protéines fluorescentes, des séquences d’illumination laser à plusieurs longueurs d’onde sont générées et envoyées dans un microscope. Les protéines étudiées émettent une fluorescence verte et lorsqu’elles sont illuminées par de la lumière violette (autour de 405 nm), elles subissent une photoconvertibilité irréversible et émettent du rouge.

Grâce au microscope super-résolution, l’étude des protéines fluorescentes se fait à l’échelle de la molécule unique. L'étude de leur comportement photophysique permet d'optimiser leurs conditions d’illumination, et d'améliorer leurs performances. Pour cela, des échantillons de protéines sont immobilisés dans un gel de polyacrylamide, puis sont positionnés sur la platine du microscope, et soumis à des séquences précises d’illumination

Un microspectrophotomètre dédié, nommé "cal(ai)²doscope", a été développé à l’IBS, en collaboration avec la start-up Optic Peter. Il est capable d’enregistrer des spectres d’absorbance et de fluorescence dans la gamme UV-visible sur des échantillons très petits. Cela permet d'étudier le comportement spectroscopique des protéines fluorescentes photoconvertibles soumises à des séquences d'illumination laser.

Des cristaux de protéines fluorescentes, illuminés de la même manière, peuvent aussi être rapidement congelés afin de réaliser des collectes de cristallographie au synchrotron européen (ESRF) qui permettront de déterminer la structure des protéines fluorescentes dans "tous leurs états".

La résonance magnétique nucléaire (RMN) apporte des informations complémentaires à la cristallographie, la spectroscopie UV-visible et l’imagerie de molécules uniques, notamment sur la dynamique et la structure chimique des différents états fluorescents et non fluorescents des protéines fluorescentes photoconvertibles. Une solution contenant ces dernières est préparée et placée dans un tube RMN.

Le tube RMN est ensuite soumis à illumination laser grâce à un banc portatif couplé à une fibre optique insérée dans le tube. Les expériences RMN sont réalisées sur la plateforme de l’IBS. Le spectromètre RMN à 800 MHz est le plus souvent utilisé pour ces expériences.

Les méthodes de RMN multidimensionnelle développées par l'IBS servent entre autre à collecter rapidement des données rapidement sous illumination laser, ou pour étudier certains aminoacides particuliers. Suite aux collectes, les données sont analysées et les signatures des protéines fluorescentes peuvent être comparées dans leurs différents états. Ainsi, il a été découvert que la protéine fluorescente mEos4b présente chez le corail cerveau lobé (Lobophylla hemprichii), dans sa forme verte existe dans deux états conformationnels différents, impossibles à distinguer par les autres méthodes. Seul l’un de ces états semble être capable de se photoconvertir efficacement vers la forme rouge.

L’amélioration des protéines fluorescentes pour la microscopie super-résolution passe par le développement de mutants aux performances accrues. Le choix des mutations à réaliser peut se faire de manière rationnelle, en analysant les résultats de cristallographie et de résonance magnétique nucléaire (RMN). Néanmoins, si certaines propriétés photophysiques sont améliorées comme attendu, d’autres sont souvent détériorées. Une mutagenèse aléatoire peut être réalisée pour pallier ces déficiences. Les mutants prometteurs sont cristallisés dans des boîtes de cristallisation de 48 puits, afin d’en obtenir la structure cristallographique. Ces structures serviront à leur tour à améliorer plus encore les marqueurs, par une boucle de rétroaction.
_ _ _
Découvrez le reportage photos complet « Des protéines fluorescentes photoconvertibles au service de la microscopie super-résolution» sur la médiathèque du CNRS.
_ _ _
Crédit photos : © Christian MOREL / IBS / CNRS Images
Texte : Dominique Bourgeois / IBS ; CNRS Alpes
Ces recherches ont été financées en tout ou partie, par l’Agence nationale de la recherche (ANR) au titre du projet ANR- STABLE-FP - AAPG2020. Cette communication est réalisée et financée dans le cadre de l’appel à projet Sciences Avec et Pour la Société - Culture Scientifique Technique et Industrielle pour les projets JCJC et PRC des appels à projets génériques 2020 (SAPS-CSTI-JCJC et PRC AAPG 20).